(2: 中国科学院南京地理与湖泊研究所,南京 210008)
(2: Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, P.R.China)
近年来我国大量湖泊呈不同程度的富营养化状态,水质恶化、生态结构破坏,影响了水体的生态平衡[1].磷是水体富营养化的主要控制因子之一[2],滇池全湖平均总磷浓度为0.23 mg/L,局部地区可高达0.51 mg/L[3],巢湖平均总磷浓度为0.24 mg/L[4],澄湖平均总磷浓度为0.23 mg/L[5],虽然这些富营养化水体中的磷仍远低于生活污水,但是依据地表水环境质量标准(GB 3838—2002),滇池和巢湖都属于劣Ⅴ类水,仅太湖属于Ⅳ类水,因此有必要控制或削减此类水体中的磷浓度,提高其水质等级.
磷在水体中的主要存在形式为颗粒态和溶解态.颗粒态磷通过沉降、过滤等方法较易去除;溶解态磷包括正磷酸盐、聚磷酸盐和有机磷,聚磷酸盐和有机磷在酸性条件下会水解为正磷酸盐,因此在除磷过程中,主要考虑对正磷酸盐的去除[6].目前用于去除水体中低浓度磷的方法主要有生物法、吸附法和化学法等.生物除磷技术主要包括人工湿地和A/O处理工艺等.人工湿地在应用过程中易受气候影响,基质易堵塞,对低浓度磷污染的自然水体净化效果不明显,而A/O处理工艺灵活、稳定性差,易发生污泥膨胀[7].吸附法主要是依靠吸附剂与污水中磷之间的物理化学反应来达到将磷从废水中分离开来的目的.Zhu[8]采用回转窑用1200℃烧成的球状陶粒做了吸收磷的实验,结果表明其最大吸附量为3.465 mg/g.Xiong等[9]利用泥煤进行除磷,研究表明该吸附剂最大除磷量为8.91 mg/g.吸附法中常用的吸附剂在除磷时吸附容量有限、易饱和,需要频繁更换[10-11].化学法则常用铝盐和铁盐等金属盐进行絮凝除磷[12-13].而目前国际上由于镧化合物与锆化合物的吸附量较大成为热门的研究除磷材料.Zhao等[14]研究发现镧-铜复合氧化物比铁盐和铝盐有更高的除磷能力,实验表明吸附剂最大吸附量为63.88 mg/g.Rodrigues等[15]研究发现,氢氧化锆是一种吸附性能好、化学稳定性和热稳定性较好的固体吸附剂,其最大吸附量为61 mg/g.虽然镧化合物与锆化合物的吸附量比传统吸附法和生物法要大,但是价格较为昂贵.因此为了去除自然水体中的低浓度磷,急需寻找一种除磷能力强、成本较低并且无毒无害的除磷材料.
在自然水体中,磷酸盐会随着pH的变化发生相应的水解和电离,自然水体pH大多在6.0~9.0之间,磷酸盐的主要存在形态为HPO42-和H2PO4-[16-17].Madsen等[18]指出,当水体pH值大于9.5时,磷酸根离子主要以HPO42-存在,Ca2+与HPO42-容易形成非晶体的磷酸钙沉淀,所生成的磷酸钙可进一步转变成稳定的羟基磷酸钙沉淀,它是自然界中最难溶的化合物之一,溶度积Ksp=6.8×10-37[19-20].且钙离子与磷酸根在碱性条件下结合形成羟基磷酸钙的现象在自然界是普遍存在的.Strang等[21]在研究含石灰石滤池的稳定塘系统时发现,稳定塘中磷的去除主要是通过与Ca2+反应生成沉淀,经分析塘底部沉淀物质中的钙磷比例证实该沉淀是羟基磷酸钙.Ke等[22]在研究人工湿地中沉水植物深度除磷时发现,沉水植物的强光合作用提高了水中的pH,磷酸盐与Ca2+在碱性条件下反应生成羟基磷酸钙.这些对碱性条件下钙离子除磷机理的研究说明吸附剂若能同时提供碱性条件和钙离子,将可能具有较好的除磷效果.过氧化钙CaO2是一种难溶于水的无毒无害、兼具释氧性和氧化性的环境友好型无机过氧化物[23-24].同时CaO2在水中会缓慢地与水体发生反应释放出氧气、氢氧根以及钙离子,不会产生有毒的副产物,对周围的环境影响很小,并且释放出的氢氧根会导致水体的pH呈弱碱性,能让钙离子更好地与磷酸根反应[25].因此本文将采用过氧化钙作为吸附剂进行研究.
本文主要通过以下几个方面开展CaO2对磷酸盐吸附特性研究:(1)考察CaO2对磷的吸附等温线,确定其最大吸附量;(2)考察温度对CaO2除磷效果的影响,建立吸附热力学模型;(3)研究CaO2在不同浓度下的除磷速率,建立吸附动力学模型;(4)探讨pH和共存阴离子对CaO2除磷效果的影响.
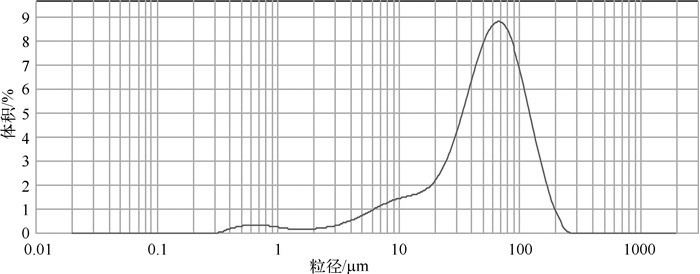
1 材料与方法 1.1 实验材料与仪器CaO2粒度通过英国Malvem出厂的MastSizer 2000型激光粒度分析仪进行测定,结果如图 1所示,粒度中值为52.481μm,粒度主要集中在7.586~158.489μm,粒度峰值为60.256~69.183μm.pH采用梅特勒-托利多实验室pH计(FE20)测定,吸光度采用752紫外-可见分光光度计测定,震荡过程采用HZ-9511K恒温震荡器来完成,磷酸盐采用钼酸铵分光光度法测定[26].
|
图 1 CaO2粒径分布 Fig.1 Distribution of CaO2 particle size |
分别称取0.05 g CaO2放入7个250 ml的锥形瓶中,依次加入50、100、150、200、250、300、400 mg/L的KH2PO4溶液50 ml.然后置于恒温摇床中以140转/min在25℃下震荡24 h,待震荡完成后在3000转/min下离心5 min,最后测定上清液中磷酸盐的浓度.CaO2的吸附量按式(1)来计算:
| $ {Q_t} = ({C_0} - {C_t}) \cdot V/m $ | (1) |
式中,Qt为t时刻吸附剂对磷的吸附量(mg/g),C0为磷的初始质量浓度(mg/L),Ct为t时刻上清液磷的质量浓度(mg/L),V为溶液体积(L),m为吸附剂的质量(g).
在温度恒定的条件下,吸附剂对磷酸盐的吸附现象采用Langmuir(式2)和Freundlich(式3)模型进行拟合,来表征其表面吸附量以及溶质平衡浓度之间的关系.
| $ \frac{{{C_{\rm{e}}}}}{{{q_{\rm{e}}}}} = \frac{{{C_{\rm{e}}}}}{{{q_{{\rm{max}}}}}} + \frac{1}{{{K_{\rm{L}}}\cdot {q_{{\rm{max}}}}}} $ | (2) |
| $ {\rm{ln}}{q_{\rm{e}}} = {\rm{ln}}{K_{\rm{f}}} + {\rm{ln}}{C_{\rm{e}}}/n $ | (3) |
式中,Ce是溶液中磷的平衡质量浓度(mg/L),qe是吸附剂吸附平衡的能力(mg/g),qmax是吸附剂吸附磷的理论最大能力(mg/g),KL是吸引力常数(L/mg),Kf(mg/g)和n是Freundlich常数.
1.2.2 吸附剂对磷酸盐的吸附热力学分别称取0.05 g CaO2放入7个250 ml的锥形瓶中,依次加入50、100、150、200、250、300、400 mg/L的KH2PO4溶液50 ml.然后置于恒温摇床中以140转/min震荡24 h,待震荡完成后在3000转/min下离心5 min,最后测定上清液中磷酸盐的浓度.改变温度(5、25、40℃)进行对比实验.CaO2对磷酸盐的吸附热力学参数通过式(4)、(5)、(6)来计算:
| $ \Delta {G^0} = \Delta {H^0} - T\cdot \Delta {S^0} $ | (4) |
| $ {K_{\rm{d}}} = {q_{\rm{e}}}/{C_{\rm{e}}} $ | (5) |
| $ {\rm{ln}}{K_{\rm{d}}} = \frac{{\Delta {S^0}}}{R} - \frac{{\Delta {H^0}}}{{R\cdot T}} $ | (6) |
式中,ΔS0、ΔH0和ΔG0分别是吸附过程中的熵变、焓变和吉布斯自由能;R是气体常数,为8.314;T是温度(K).
1.2.3 吸附剂对磷酸盐的吸附动力学分别称取0.005 g CaO2放入3个1000 ml的锥形瓶中和0.5 g CaO2放入1000 ml的锥形瓶中,依次加入0.5、1、5、100 mg/L的KH2PO4溶液500 ml,然后置于恒温摇床中以140转/min进行连续震荡.隔1、2、3、4、5、7、10、15、20、25、30、40、50、60、90、120 min后,通过水系针头滤器(13 mm× 0.45μm)从锥形瓶中抽取1 ml并过滤定容到25 ml,测定溶液液中磷的浓度.CaO2对磷酸盐的吸附动力学采用Pseudo-first-order(式7)和Pseudo-second-order(式8)模型拟合:
| $ {\rm{lg}}\left( {{q_{\rm{e}}} - {q_t}} \right) = {\rm{lg}}\;{q_{\rm{e}}} - \frac{{{k_1}\cdot t}}{{2.303}} $ | (7) |
| $ \frac{t}{{{q_t}}} = \frac{1}{{{k_2}\cdot q_{\rm{e}}^{^2}}} + \frac{t}{{{q_{\rm{e}}}}} $ | (8) |
式中,qe(mg/g)和qt(mg/g)分别是吸附量平衡时和吸附时间t时刻的吸附含量,k1(min-1)是Pseudo-first-order的吸附速率常数,k2(mg/(g·min))是Pseudo-second-order的平衡速率常数.
1.2.4 pH值对吸附剂除磷性能的影响分别称取0.005 g CaO2放入8个250 ml的锥形瓶中,依次加入1 mg/L的KH2PO4溶液500 ml.用0.1 mol/L的NaOH和0.01 mol/L的HCl溶液将初始溶液的pH值调至4、5、6、7、8、9、10、11.然后置于恒温摇床中以140转/min进行连续震荡吸附.温度25℃下震荡24 h,待震荡完成后在3000转/min下离心5 min,最后测定上清液中磷的浓度.
1.2.5 共存阴离子对吸附剂除磷效果的影响将0.05 g CaO2投入到50 ml含干扰离子的含磷酸盐吸附液中(其中磷酸盐浓度为200 mg/L,干扰离子浓度为200 mg/L和2000 mg/L),并设置空白对照组.然后置于恒温摇床中以140转/min进行连续震荡吸附.温度25℃震荡24 h,待震荡完成后在3000转/min下离心5 min,最后测定上清液中磷的浓度.其中干扰离子包括F-、Cl-、NO3-、SO42-和CO32-,干扰离子主要通过钠盐(NaF、NaCl、NaNO3、Na2SO4、Na2CO3)的形式投加到吸附液中.
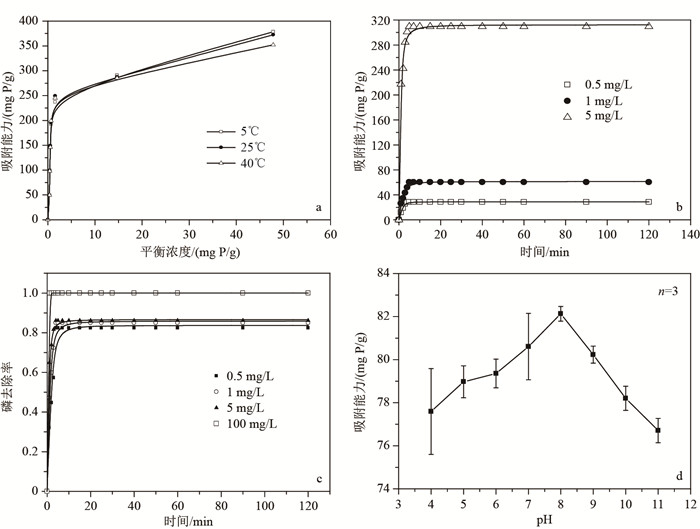
2 结果与分析 2.1 吸附剂对磷酸盐的等温吸附拟合曲线CaO2在5、25、40℃下的吸附等温线如图 2a所示,在25℃下CaO2对磷酸盐的最大吸附量达到了381.7 mg/g,并且随着温度的升高除磷效果逐渐减弱.CaO2对磷酸盐的Langmuir和Freundlich拟合等温吸附方程相关参数如表 1所示.
|
图 2 CaO2对磷酸盐的吸附等温线(a);CaO2对不同初始浓度磷溶液的吸附量(b)和去除动力学曲线(c);初始pH值对磷吸附能力的影响(d) Fig.2 Adsorption isotherms(a); CaO2 adsorption of different initial concentrations of phosphorus solution(b); the kinetics curve of phosphorus removal(c); the influence of the initial pH value(d) |
| 表 1 CaO2的等温吸附方程及相关参数 Tab.1 Langmuir and Freundlich isotherms parameters in the phosphate adsorption by using CaO2 |
通过CaO2在不同温度(5、25、40℃)下得到的吸附等温线,以lnKd对
从图 2b、图 2c可以看到不同浓度下CaO2除磷的动力学特征,CaO2对磷酸根的吸附存在一个吸附平衡(图 2b).吸附开始时,吸附速率随时间呈直线上升趋势,在4 min左右达到平衡状态.这是因为吸附开始时溶液中磷酸根浓度较高;随着吸附时间的延长,吸附速率减缓最终达到平衡状态.采用Pseudo-first-order和Pseudo-second-order动力学模型对磷的吸附动力学进行拟合,参数结果如表 2所示.
| 表 2 CaO2在不同初始浓度下的除磷动力学模型和相关参数 Tab.2 The pseudo-first-order and pseudo-second-order model constants and correlation coefficients by using CaO2 in the phosphate solution of different initial concentrations |
pH对CaO2的除磷效果影响明显,在pH为4~7时CaO2的除磷效果随着pH的升高而升高,pH为7~9时CaO2的吸附量较大且较为稳定,在pH为9~11时CaO2的除磷效果随着pH的升高而降低,即在偏碱性条件下CaO2的除磷效果较好(图 2d).
2.5 共存阴离子对吸附剂除磷性能的影响在共存阴离子与磷酸根质量浓度为1: 1时,对CaO2的除磷效果并没有太大的影响,当共存阴离子与磷酸根质量浓度比为1 : 10时,CO32-和F-对CaO2的除磷不利,影响较大的是CO32-,其他共存阴离子也有一定的干扰能力,但干扰效果不明显(表 3).
| 表 3 不同浓度共存阴离子对CaO2除磷效果的影响 Tab.3 Effect of coexisting anions and their concentrations on the phosphate adsorption capacity by using CaO2 |
Langmuir方程是基于单分子层假设推导得出的,可以通过它估算出吸附剂对磷的理论饱和吸附量;Freundlich方程是基于经验数据拟合提出的,是一种单组分吸附平衡的经验描述,可以用来描述吸附剂对磷的吸附能力大小[27].由表 1可以看出,CaO2达到吸附平衡时,其除磷行为较符合Langmuir方程,属单分子层的化学吸附[28].由Langmuir方程计算出CaO2在25℃时的最大吸附量为381.7 mg/g,随着温度的升高最大吸附量稍有降低.
与其他一些吸附剂的除磷效果相比,CaO2的除磷效果是非常好的,具体结果如表 4所示.比较发现CaO2的除磷效果是传统吸附材料的3~10倍,是近年来一些热门材料的5~28倍,可见使用CaO2是一种非常好的除磷选择.
| 表 4 不同吸附剂除磷效果比较 Tab.4 Comparison of phosphorus removal effect of different adsorbents |
通过吸附热力学的研究,可以了解吸附过程进行的趋势、程度和驱动力.因此,根据吸附实验数据计算标准热力学函数的变化,是吸附热力学研究的重要内容,具有理论和实际意义.由热力学参数可知CaO2的除磷过程.一方面,CaO2在对磷酸盐的吸附过程中ΔH0<0,表明它的除磷过程是一个放热过程.另一方面,吉布斯自由能ΔG0<0,说明它的除磷过程是一个自发的过程,即CaO2对磷的作用力大于吸附剂与被吸附剂之间的能量势垒,随着温度的升高,体系的ΔG0逐渐减小,表明随着温度的升高,吸附速率加快[34].另外,吸附过程的熵变ΔS0为正值,说明溶液中磷倾向于优先选择在CaO2表面吸附.因为在固液吸附体系中, 同时存在溶质的吸附和溶剂的解吸, 溶质分子吸附在吸附剂上, 自由度减小, 是熵减小的过程, 而溶剂分子的解吸是熵增大的过程,后者的作用导致系统的熵增加远大于溶液中磷被吸附所引起的熵减小,整个系统熵值增大[35-36].因此,在常温下采用CaO2进行除磷,水体中的磷酸根能自发地与其发生反应而得到去除,且在常温下CaO2的吸附量只比低温下衰减了4.6 %,即CaO2在常温也拥有很强的除磷能力.
3.3 吸附动力学吸附速率是评价吸附剂吸附性能的一个重要因素,通过吸附动力学的研究,可以了解CaO2的除磷速率以及对磷酸盐的去除率.对照表 2可以看出,CaO2对磷酸盐的吸附速率能很好地符合Pseudo-second-order方程(相关系数均大于0.99).从Ozacar[37]的研究可知,吸附速率与拟合直线的截距呈反比,因此在相同条件下,通过初始磷浓度、平衡磷浓度、平衡时间以及CaO2投加量可计算出CaO2在磷酸盐浓度为5 mg/L时吸附速率最大值为91.31 mg/(g·min),且CaO2的吸附速率会随着溶液中磷酸盐浓度的升高而升高.
由图 2c可以看出,随着磷酸盐浓度的升高,CaO2对磷的去除率也逐渐升高.在处理0.5 mg/L的磷酸盐溶液时,平衡浓度为0.09 mg/L,去除率可达82 %.当增加CaO2的投加量、处理100 mg/L的磷酸盐溶液时,平衡浓度为0.91 mg/L,去除率能达到99 %,即CaO2对磷酸盐的吸附量随着溶液中磷酸盐浓度的增加而增加.这是由于溶液浓度是影响吸附剂除磷的主要因素之一.首先,溶液浓度越高,可供基质吸附的磷就越多;其次,溶液与基质外表面液膜之间的浓度差会随着溶液浓度的升高而增大,进而导致磷向基质表明迁移的推动力增大,所以,溶液浓度的增大有利于提高基质对磷的吸附量.
3.4 pH的影响pH主要通过改变吸附剂表面的荷电特性、溶质的解离状况和溶解平衡,对吸附剂的吸附容量产生影响[38-39].当水体pH值大于9.5时,首先Ca2+与HPO42-反应生成非晶体的磷酸钙沉淀,所生成的磷酸钙再进一步转变成稳定的羟基磷酸钙沉淀(Ca5(OH)(PO4)3),反应方程式如下[40-41]:
| $ \begin{array}{l} {\rm{C}}{{\rm{a}}^{\rm{2}}}{\rm{ + O}}{{\rm{H}}^{\rm{ - }}}{\rm{ + HPO}}_{_4}^{^{2 - }} = {\rm{C}}{{\rm{a}}_{\rm{3}}}{{\rm{(P}}{{\rm{O}}_{\rm{4}}}{\rm{)}}_{\rm{2}}} \downarrow + {{\rm{H}}_{\rm{2}}}{\rm{O}}\\ {\rm{3HPO}}_{_{\rm{4}}}^{^{{\rm{2 - }}}}{\rm{ + 5C}}{{\rm{a}}^{{\rm{2 + }}}}{\rm{ + 4O}}{{\rm{H}}^{\rm{ - }}} = {\rm{C}}{{\rm{a}}_{\rm{5}}}\left( {{\rm{OH}}} \right){{\rm{(P}}{{\rm{O}}_{\rm{4}}}{\rm{)}}_3} \downarrow + {\rm{3}}{{\rm{H}}_{\rm{2}}}{\rm{O}} \end{array} $ |
在研究过程中发现,将初始溶液pH调节为8时CaO2的除磷效果最好,这是由于CaO2在水中会缓慢地与水体发生反应释放出OH-,改变材料附近水体的pH微环境,进而达到了Ca2+与HPO42-反应所需条件.对比传统的铁铝吸附材料可知,铁泥对水中磷的吸附在pH=5.5时最高[29],活性氧化铝在pH=5时对污水中磷的吸附效果最好[42].新型的稀土除磷材料,如Huang等[33]利用蛭石对氢氧化镧进行改性得到的La5EV在pH=3时除磷效果最佳,Long等[31]发现铁锆复合吸附剂进行除磷,在pH=4的时候除磷效果最好.可见,这些传统或新型的吸附材料均在偏酸性条件下才能达到最佳吸附效果,而自然水体的pH大多在6.0~9.0之间,正好符合CaO2除磷对pH的要求.
3.5 共存阴离子的影响通过共存阴离子的研究,可以了解CaO2在自然条件下除磷的抗干扰能力.在共存离子与磷酸根质量浓度比值为1 : 1时,CaO2对磷酸盐的吸附量下降最大,为5.4 %,表明CaO2具有较高的选择吸附能力;在共存离子与磷酸根质量浓度比值为1 : 10时,CO32-和F-对CaO2的除磷不利,CaO2对磷酸盐的吸附量分别下降14.7 %和8.3 %.这可能是因为共存阴离子与磷酸根离子之间对吸附位点产生竞争吸附,而吸附剂上的吸附位点数量是一定的,共存阴离子占据了其中的一部分吸附位点,致使可用磷酸根离子吸附位点数减少,抑制了Ca-P的生成,从而降低CaO2的除磷效果[43].
4 结论针对低浓度磷酸盐的去除,从多个方面考察了CaO2的除磷特性.结果表明:CaO2对磷的去除高度符合Langmuir方程,属于单分子层的化学吸附,理论上对磷的最大吸附量为381.7 mg/g(25℃),远高于镧铁复合吸附剂和锆铁复合吸附剂等;通过二级动力学能够很好地描述CaO2的吸附行为,它的吸附速率随着溶液中磷酸盐浓度的升高而升高,并且吸附量随着溶液浓度的增大而增大;在常温下,CaO2的除磷反应是一个自发的、放热过程;在处理低浓度的磷酸盐溶液时,CaO2的最佳pH为8.0,并且有很强的抗共存阴离子干扰的能力.
5 建议和展望CaO2的除磷产物羟基磷酸钙是一种非常稳定、无毒、无害且可回收的化合物,在处理0.5 mg/L的低浓度磷酸盐溶液时,平衡浓度为0.09 mg/L.因此可以使用CaO2作为低污染的天然水体的除磷选择,不仅有低成本、高效、无二次污染等优点,而且处理后水体可达到地表水环境质量标准(GB3838—2002)中规定的Ⅲ类水标准.
CaO2难溶于水,但是在水中又能发生极为缓慢的分解反应,因此可以考虑将CaO2粉末在高压力下制成20~50mm直径的球体,作为潜流式人工湿地的填料使用,利用其优异的除磷特性,对低污染河水等进行深度净化.另外,也可以考虑将其应用于处理低污染的天然水体,在水体表面布设若干浮体,其中填充适量CaO2颗粒或将其压制成多面形体,采用自然能源使水体循环并流经除磷材料,实现持久而高效地除磷.
| [1] |
陈永焦. 浅谈我国水污染现状及治理对策. 科技信息, 2010(11): 381-382. DOI:10.3969/j.issn.1001-9960.2010.11.298 |
| [2] |
苗文凭, 林海, 卢晓君. 粉煤灰吸附除磷的改性研究. 环境工程学报, 2008, 2(4): 502-506. |
| [3] |
史丽琼. 滇池水体及表层沉积物水界面各形态磷分布特征研究[学位论文]. 昆明: 昆明理工大学, 2011.
|
| [4] |
李强. 巢湖流域氮磷的分布特征及其相关性研究[学位论文]. 武汉: 武汉纺织大学, 2013.
|
| [5] |
陈小华, 李小平, 王菲菲等. 苏南地区湖泊群的富营养化状态比较及指标阈值判定分析. 生态学报, 2014, 34(2): 390-399. |
| [6] |
Yildiz E. Phosphate removal from water by fly ash using crossflow microfiltration. Separation and Purification Technology, 2004, 35(3): 241-252. DOI:10.1016/S1383-5866(03)00145-X |
| [7] |
黄锦楼, 陈琴, 许连煌. 人工湿地在应用中存在的问题及解决措施. 环境科学, 2013, 34(1): 401-408. |
| [8] |
Zhu T. Phosphorus sorption and chemical characteristics of light weight aggregates (LWA)-potetial filter media in treatment wetlands. Water Science and Technology, 1997, 35(5): 103-108. DOI:10.2166/wst.1997.0175 |
| [9] |
Xiong JB, Mahmood Q. Adsorptive removal of phosphate from aqueous media by peat. Desalination, 2010, 259: 59-64. DOI:10.1016/j.desal.2010.04.035 |
| [10] |
Chouyyok W, Wiacek RJ, Pattamakomsan K et al. Phosphate removal by anion binding on functionalized nanoporous sorbents. Environmental Science and Technology, 2010, 44: 3073-3078. DOI:10.1021/es100787m |
| [11] |
Liu JY, Wan LH, Zhang L et al. Effect of pH, ionic strength, and temperature on the phosphate adsorption onto lanthanum-doped activated carbon fiber. Journal of Colloid and Interface Science, 2011, 364: 490-496. DOI:10.1016/j.jcis.2011.08.067 |
| [12] |
Dian KM, Zhang BG, Feng CP. Phosphorus removal by electrochemical using aluminum electrode. Advanced Materials Research, 2013, 864/865/866/867: 1240-1243. |
| [13] |
Long F, Gong L, Zeng GM et al. Removal of phosphate from aqueous solution by magnetic Fe-Zr binary oxide. Chemical Engineering Journal, 2011(3): 1-8. |
| [14] |
Zhao LL, Yang YZ, Zhang M. Preparation and characterization of phosphorus removal agent by Lanthanum-Copper Composite Oxide. Advanced Materials Research, 2014, 887/888: 26-31. DOI:10.4028/www.scientific.net/AMR.887-888 |
| [15] |
Rodrigues LA, Maschio LJ, Coppio LS et al. Adsorption of phosphate from aqueous solution by hydrous zirconium oxide. Environmental Technology, 2012, 33(12): 1345-1351. DOI:10.1080/09593330.2011.632651 |
| [16] |
Grubb DG, Guimaraes MS, Valencia R. Phosphate immobilization using an acidic type F fly ash. Journal of Hazardous Materials, 2000, 76(2/3): 217-236. |
| [17] |
Zhang JD, Shen ZM, Shan WP et al. Adsorption behavior of phosphate on Lanthanum(Ⅲ) doped mesoporous silicates material. Journal of Environmental Sciences, 2010, 22(4): 507-511. DOI:10.1016/S1001-0742(09)60141-8 |
| [18] |
Madsen HEL, Christensson F, Polyak LE et al. Calcium phosphate crystallization under terrestrial and microgravity conditions. Journal of Crystal Growth, 1995, 152: 191-202. DOI:10.1016/0022-0248(95)00113-1 |
| [19] |
徐微, 吕锡武. 诱导结晶磷回收技术处理低浓度含磷废水研究. 环境科学与技术, 2011, 34(12): 119-123. DOI:10.3969/j.issn.1003-6504.2011.12.025 |
| [20] |
Uysala A, Yilmazel YD, Demirer GN. The determination of fertilizer quality of the formed struvite from effluent of a sewage sludge anaerobic digester. Journal of Hazardous Materials, 2010, 181(1/2/3): 248-254. |
| [21] |
Strang TJ, Wareham DG. Phosphorus removal in a waste-stabilization pond containing limestone rock filters. Journal of Environmental Engineering and Science, 2006, 5(6): 447-457. DOI:10.1139/s06-017 |
| [22] |
Ke F, Li WC, Xiong F. Advanced phosphorus removal for secondary effluent using a natural treatment system. Water Science and Technology, 2012, 65(8): 1412-1419. DOI:10.2166/wst.2012.003 |
| [23] |
张静, 周雪飞, 钱雅洁. 过氧化钙在环境修复应用中的研究进展. 环境化学, 2014, 33(2): 321-326. DOI:10.7524/j.issn.0254-6108.2014.02.015 |
| [24] |
梅允福. 过氧化钙的制造和应用. 福建化工, 2000(2): 3-5. |
| [25] |
张军毅, 黄君, 严飞等. 梅梁湖水体溶解氧特征及其与pH的关系分析. 复旦学报:自然科学版, 2009, 48(5): 623-627. |
| [26] |
国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法:第4版. 北京: 中国环境科学出版社, 2002.
|
| [27] |
Mann RA, Bavor HJ. Phosphorus removal in constructed wetlands using gravel and industrial waste substrata. Water Science and Technology, 1993, 27(5): 107-113. |
| [28] |
Yang J, Zhou L, Zhou LZ et al. A designed nanoporous material for phosphate removal with high efficiency. Journal of Materials Chemistry, 2011, 21: 2489-2494. DOI:10.1039/c0jm02718a |
| [29] |
Song XY, Pan YQ, Wu QY et al. Phosphate removal from aqueous solutions by adsorption using ferric sludge. Desalination, 2011, 280: 384-390. DOI:10.1016/j.desal.2011.07.028 |
| [30] |
Shi ZL, Liu FM, Yao SH. Adsorptive removal of phosphate from aqueous solutions using activated carbon loaded with Fe(Ⅲ)oxide. New Carbon Materials, 2011, 26(4): 299-306. DOI:10.1016/S1872-5805(11)60083-8 |
| [31] |
Long F, Gong JL, Zeng GM et al. Removal of phosphate from aqueous solution by magnetic Fe-Zr binary oxide. Chemical Engineering Journal, 2011, 171(2): 448-455. DOI:10.1016/j.cej.2011.03.102 |
| [32] |
Liu JY, Zhou Q, Chen JH et al. Phosphate adsorption on hydroxyl-iron-lanthanum doped activated carbon fiber. Chemical Engineering Journal, 2013, 215/216: 859-867. DOI:10.1016/j.cej.2012.11.067 |
| [33] |
Huang WY, Dan L, Liu ZQ et al. Kinetics, isotherm, thermodynamic, and adsorption mechanism studies of La(OH)3-modified exfoliated vermiculites as highly efficient phosphate adsorbents. Chemical Engineering Journal, 2014, 236: 191-201. DOI:10.1016/j.cej.2013.09.077 |
| [34] |
El-Shahawi MS, Nassif HA. Retention and thermodynamic characteristics of mercury(Ⅱ) complexes onto polyurethane foams. Analytica Chimica Acta, 2003, 481: 29-39. DOI:10.1016/S0003-2670(03)00074-6 |
| [35] |
舒月红, 贾晓珊. CTMAB-膨润土从水中吸附氯苯类化合物的机理-吸附动力学与热力学. 环境科学学报, 2005, 25(11): 1530-1536. DOI:10.3321/j.issn:0253-2468.2005.11.016 |
| [36] |
Rodrigues LA, da Silva MLCP. Thermodynamic and kinetic investigations of phosphate adsorption onto hydrous niobium oxide prepared by homogeneous solution method. Desalination, 2010, 263: 29-35. DOI:10.1016/j.desal.2010.06.030 |
| [37] |
Ozacar M. Equilibrium and kinetic modeling of adsorption of phosphorus on calcined alunite. Adsorption, 2003, 9: 125-132. DOI:10.1023/A:1024289209583 |
| [38] |
Yan LG, Xub YY, Yu HQ et al. Adsorption of phosphate from aqueous solution by hydroxy-aluminum, hydroxy-iron and hydroxy-iron-aluminum pillared bentonites. Journal of Hazardous Materials, 2010, 179: 244-250. DOI:10.1016/j.jhazmat.2010.02.086 |
| [39] |
胡筱敏, 李微, 刘金亮等. pH对以亚硝酸盐为电子受体反硝化除磷的影响. 中南大学学报:自然科学版, 2013, 44(5): 2144-2149. |
| [40] |
王荣, 贺锋, 徐栋等. 人工湿地基质除磷机理及影响因素研究. 环境科学与技术, 2010, 33(6E): 12-17. |
| [41] |
Arias CA, Bubba MD, Brix H. Phosphorus removal by sands for use as media in subsurface flow constructed reed beds. Water Research, 2001, 35(5): 1159-1168. DOI:10.1016/S0043-1354(00)00368-7 |
| [42] |
常会庆, 徐晓峰. 活性氧化铝去除不同浓度污水中磷的研究. 水土保持学报, 2013, 27(4): 181-185. |
| [43] |
于建, 梁文艳, 汪丽. 共存物质对钢渣除磷的影响. 环境工程学报, 2012, 6(12): 4268-4274. |
 2015, Vol. 27
2015, Vol. 27 

