(2: 中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,南京 210008)
(3: 贵州大学动物科学学院,贵阳 550025)
(2: State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, P. R. China)
(3: College of Animal Science, Guizhou University, Guiyang 550025, P. R. China)
水体富营养化是我国湖泊所面临的最主要的生态环境问题之一,尤其是长江中下游地区的许多湖泊都暴发了严重的蓝藻水华[1].为此,人们采用了一系列方法来控制水体富营养化,其中生物治理引起了国内外学者的极大关注[2-4].双壳贝类是淡水生态系统常见的滤食性动物,以浮游植物和有机悬浮颗粒物为食,被称为“生态系统工程师”,在水域生态系统中起着重要的作用[5-6].
国内外学者证实淡水贝类具有降低水体叶绿素a浓度、改善水质的功能. Naddafi等[7]对斑马贻贝(Dreissena polymorpha)入侵后生态系统物种的响应和种间关系的影响开展了广泛研究,发现斑马贻贝可以通过高强度的滤食增加水体透明度,直接或间接地改变浮游植物和沉水植物群落结构. Hosper[8]在荷兰的一些湖泊中发现,当贝类的滤食强度增加到一定程度并超过藻类生长潜力时,就可以在营养水平较高的情况下抑制浮游藻类的生长. Caraco等[9]认为河蚬(Corbicula fluminea)种群的定居和扩展是美国哈德逊(Hudson)河中浮游藻类减少和群落结构改变的主要因素.杨东妹等[10]利用模拟的微型生态系统研究背角无齿蚌(Anodonta woodiana)对水体中浮游藻类群落结构和不同形态氮、磷浓度的影响,发现背角无齿蚌能够显著减少浮游藻类的数量和生物量以及悬浮态氮的含量,提高水体透明度,改变微型生态系统中浮游藻类的群落结构.费志良等[11]发现三角帆蚌(Hyriopsis cumingii)对池塘中的悬浮物和叶绿素a的消除率分别达到76%和94%,水体透明度提高近二倍,且消除率均随水温升高而提高,水质改良效果非常明显.
国内外对于背角无齿蚌、三角帆蚌及褶纹冠蚌(Cristariaplicata leach)[12]等已有较多研究,而有关河蚬改善水质的研究较少.河蚬属瓣腮纲双壳类软体动物[13],为太湖的优势底栖动物,也是太湖中仅次于银鱼的第二大创汇水产资源[14].本研究通过设计受控实验,研究不同密度的河蚬对富营养水体的水质改善效果,探讨河蚬在富营养水体生态修复中的作用以及在太湖生态系统中的生态学意义.
1 材料与方法室外受控实验于2013年11月5—17日在东太湖水体农业试验站(31°1′54″N, 120°25′35″E)进行.实验所用容器为聚乙烯塑料桶(桶高56 cm,上、下底直径分别为50、38 cm),实验开始前向桶内添加10 cm厚的沉积物,并注入70 L经500目筛网过滤的东太湖湖水,水体总氮(TN)、总磷(TP)和叶绿素a(Chl.a)的初始浓度分别为2.00±0.25 mg/L、0.07±0.01 mg/L和24.43±2.41 μg/L.沉积物来自梅梁湾一河道表层,经过60目的筛绢网过筛混匀后使用,其初始TN、TP和有机质(OM)含量分别为3.24±0.07 mg/g、0.57±0.20 mg/g和7.85% ±0.03%.为了模拟风浪扰动,每桶内放置一小型造浪泵(功率为3 W,扬程为0.5 m),放置位置为水面下10 cm,预实验表明水泵的扰动不会引起沉积物的再悬浮.同时在各桶内贴近底泥处放置1块硬塑料板(8 cm×10 cm),以采集水底层的附着生物.
河蚬密度为实验的唯一影响因子,设4组处理,分别为无河蚬对照组、低密度河蚬组(10只/桶,130 g/m2)、中密度河蚬组(20只/桶,260 g/m2)和高密度河蚬组(40只/桶,520 g/m2)(分别简称为对照组、低蚬组、中蚬组、高蚬组),每个处理4个重复.河蚬密度的设定参考太湖河蚬的自然丰度[15-16],中密度组为太湖河蚬平均密度,低密度组为中密度组的1/2,高密度组为中密度组的2倍.实验期间观察河蚬生长状况,做好天气记录,及时补充湖水以保证水位不变.实验期间桶内平均水温为14.7℃(范围为12~19℃).
采样于实验开始的第0、2、4、6、8、10、12 d进行,测定水体TN、TP浓度和Chl.a含量,其方法依据《湖泊生态调查观测与分析》[17];悬浮物浓度分析方法参照《湖泊富营养化调查规范》[18].时间序列数据采用重复测量方差分析(rANOVA)进行比较,附着生物生物量采用单因素方差分析(One-way ANOVA)进行,两两比较采用最小显著差别(LSD)方法.所有实验数据采用SPSS 19.0进行统计分析,图形由Excel 2007绘制.
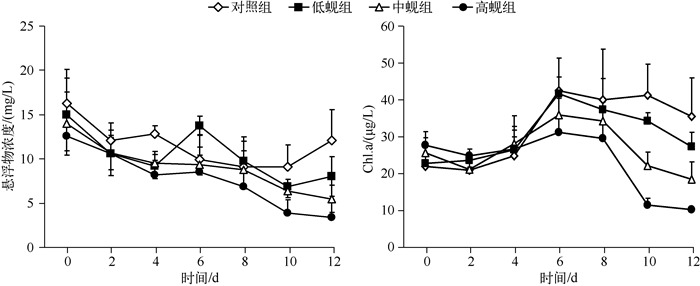
2 结果 2.1 悬浮物与Chl.a浓度变化河蚬滤食对水体悬浮物浓度有极显著影响(P<0.01)(图 1).实验结束时,低、中、高蚬组悬浮物浓度分别为8.01、5.50、3.42 mg/L,较对照组(12.08 mg/L)分别下降了20.85%、34.90%、53.79%.两两比较(LSD法)表明各处理之间悬浮物浓度均具有显著差异,表现为对照组>低蚬组>中蚬组>高蚬组,说明河蚬能促进悬浮物沉降,并且河蚬密度越大,对水体悬浮浓度的影响越明显.实验期间,各处理组悬浮物浓度均表现为前期(0~4 d)下降较快,中期趋于稳定(4~8 d),后期(8~12 d)下降缓慢的趋势.
|
图 1 河蚬对水体悬浮物浓度和Chl.a的影响 Fig.1 Effects of C.fluminea on suspended matter and chlorophyll-a concentration in water |
rANOVA分析表明,水体Chl.a浓度与河蚬密度呈极显著负相关(P<0.01),河蚬密度越高,水体Chl.a浓度越低(图 1).实验结束时,低蚬组、中蚬组和高蚬组的Chl.a浓度分别为27.14、18.28和10.20 μg/L,较对照组(35.38 μg/L)分别降低了23.29%、48.32%和71.17%.各处理组Chl.a浓度随时间变化呈先上升后下降的趋势,不同处理组的下降速率存在极显著差异(P<0.01).
2.2 氮、磷浓度变化河蚬添加显著降低了水体的TN浓度(P<0.01)(图 2).实验结束时低、中和高蚬组的水体TN浓度分别下降了50.45%、50.56%和46.15%,下降幅度显著高于对照组;而高蚬组与中蚬组差异不显著(P>0.05).不同密度河蚬对水体TP的影响有显著差异(P<0.05)(图 2),高、中蚬组水体TP分别下降了79.53%、81.94%,显著高于低蚬组(55.23%)和对照组(33.50%)(P<0.01);而高蚬组与中蚬组差异并不显著(P>0.05).

|
图 2 河蚬对水体TN和TP浓度的影响 Fig.2 Effects of C.fluminea on TN and TP concentrations in water |
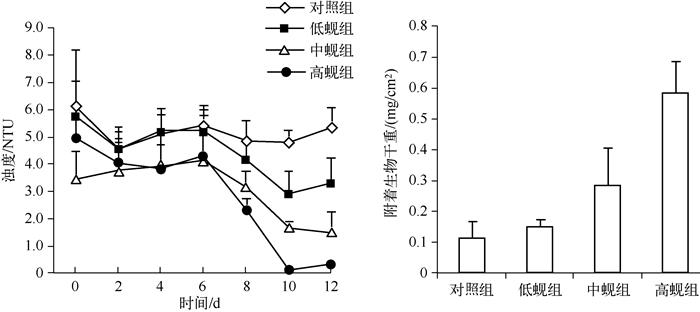
河蚬可显著降低水体浊度(P<0.01)(图 3).实验结束时,除低蚬组与对照组的水体浊度差异不显著外(P>0.05),其余处理组间均具有极显著差异(P<0.01).低、中、高蚬组水体浊度较初始值分别下降了42.86 %、55.80%、93.94%,说明河蚬密度越大水体浊度降低效果越明显.
|
图 3 河蚬对水体浊度及水体底层附着生物干重的影响 Fig.3 Effects of C. fluminea on water turbidity and dry weight of periphyton on the bottom of the water |
河蚬密度对水体底层的附着生物生物量具有极显著的促进作用(P<0.01)(图 3).实验结束时,高蚬组的附着生物干重(0.58 mg/cm2)显著高于对照组(0.11 mg/cm2)、低蚬组(0.15 mg/cm2)和中蚬组(0.29 mg/cm2)(P<0.05),但对照组和低蚬组差异不显著(P>0.05).由此可见,河蚬密度越高底栖附着生物干重就越大,河蚬可以促进水体底层的附着生物生长.
3 讨论河蚬是一种原产于我国的淡水双壳类,现已广泛分布于世界各地,其较强的环境适应能力和对各种污染物质的显著吸收、富集作用使其成为重要的环境指示生物[19].国内外研究表明,河蚬以浮游植物和有机物碎屑为食,通过生物过滤作用和生物沉积作用去除水体中悬浮的颗粒物质,降低水体Chl.a浓度,从而改善水下光照条件和透明度,并且通过增加对营养元素的消耗,加快N、P等营养元素向沉积物中迁移[20].本实验结果表明,随密度增加,河蚬不仅可以大幅度降低水体悬浮物与Chl.a浓度和水体浊度,还可以有效降低TN、TP含量,起到净化水质的作用.
河蚬通过滤(刮)食作用去除有机、无机颗粒物是降低水体悬浮物和叶绿素浓度的主要机制. Hakenkamp等[21]和McMahon[22]的研究发现,河蚬的滤食系统十分发达,不仅可以通过吸管滤食,还可以通过斧足上的纤毛在沉积物表层摄食. Asmus等[23]认为,河蚬通过改变滤食率来适应外界食物条件的变化:当颗粒物浓度增加时,其滤食率下降,但其吸收率增加;当食物中有机物含量减少时,其滤食率增大,可产生更多的假粪,将其不能全部利用的物质以粪和假粪的形式形成生物沉积,起到净化水质的作用.本实验中加蚬组的水体悬浮物与Chl.a浓度以及浊度均低于对照组,而且河蚬密度越高这3项指标下降率越大.这与刘旭博等[24]的研究一致,他们发现三角帆蚌的密度越高,其对浮游植物等的滤食压力就越大,改善水质效果越显著.实验前6天,各处理组Chl.a浓度均呈增长趋势,一方面可能是因为河蚬适应新环境需要一定时间,还未开始滤食藻类或滤食较少;另一方面藻类会吸收水中营养盐促进自身生长而导致实验初期Chl.a浓度增加,但这并不影响分析河蚬对Chl.a的消除作用.另外,河蚬的滤食作用会打破底栖藻类和浮游藻类间的竞争平衡而导致浮游藻类生长缓慢,也是造成水体Chl.a浓度降低的重要原因.浮游藻类相对于生活在沉积物表面的附着藻类对光照有竞争优势[25],而底栖藻类可以直接利用沉积物中的营养盐,在营养盐竞争方面有优势[26].本研究显示,河蚬可降低浮游藻类生物量,使得水体浊度下降,增加到达水体底部的光照,促进水体底层附着藻类的生长,而其大量生长不仅有利于打破原有的竞争平衡,还利于系统由浊水态向清水态转变.
实验结果还表明,河蚬可以显著降低水体氮、磷浓度.一方面河蚬对有机悬浮颗粒物的高强度滤食会加快物质循环速率,它所致的生物沉积作用也使颗粒态氮、磷实现从水体向底层搬运的过程,直接降低水体TN、TP含量.另一方面,河蚬通过滤食作用改善水下光照条件后促进附着藻类生长,附着藻类通过光合作用和固氮作用改变水体中的pH值、溶解氧、氧化还原电位等理化条件,促进水体中营养盐的沉降并且可以阻断营养盐从沉积物的释放[27].另外,附着藻类与磷之间有很高的亲合力,对周围水柱中磷的吸收比较迅速[28].因此,附着生物的生物量越高,对去除水体氮、磷的作用越明显[29].张雷等[30]发现,河蚬活动使沉积物间隙水中的Fe2+被部分氧化,氧化生成的水合铁氧化物吸附间隙水中的溶解性反应磷并沉积到沉积物颗粒上,从而减小间隙水中溶解性反应磷的浓度,降低沉积物再悬浮时营养盐向上覆水释放的可能,也是导致本实验加蚬组TP浓度下降的原因之一.实验结束时高蚬组的TN、TP浓度与中蚬组差异不显著(P>0.05),可能是由于本实验高蚬组的放养密度较大,底栖软体动物生理分泌及排泄物的释放、积累将明显影响水质;还可能与细菌分解有机碎屑的微食物网有关,Lohner等[31]和Bruesewitz等[32]的研究表明,斑马贻贝的存在可以促进硝化细菌的硝化作用,增加水体中可利用NO3--N的含量.是否本实验中高蚬组因密度大,导致溶解态氮、磷上升,使得TN、TP下降缓慢也具有相似机理,还需要进一步研究.因此,河蚬由净化者转为污染者的关键就在于密度,为此国内外许多学者就放养贝类是加速还是减缓水体富营养化的问题得出了不同的结论:Kautsky等[33]的研究认为水域中放养贝类会显著加速水体的富营养化,贝类的代谢产物在鱼类游动的搅水作用和贝类的滤食活动作用下可增加水层中营养物质特别是N、P含量并促进其循环,从而促进浮游植物的生长,而水体中三角帆蚌等滤食性动物的存在使得浮游动物被大量滤食,导致水华暴发;杨东妹等[10]、徐海军等[34]的研究则认为贝类滤食作用使浮游植物的生物量下降,可以减缓水体富营养化.除了水体条件不同之外,造成这种分歧的原因可能就在于放养密度的差异,本文的研究结果证实了河蚬对水质的净化效果良好,而密度的设置还需商榷.
河蚬在太湖水生态系统中扮演着重要角色[35],不仅可以为藻类、腹足类、淡水海绵或者其他底栖生物提供生存的基质、避难场所以及食物来源[36-37],还可以改善水下光照条件、调节营养盐循环路径与浮游—底栖的耦合关系[38],对于沉水植物的恢复与生长有重要促进作用. He等发现三角帆蚌可以减轻水华蓝藻对沉水植物生长的负面影响.在低浓度蓝藻的水体中(Chl.a=100 μg/L),有蚌组的光照强度比无蚌组高56%;而在中(Chl.a=200 μg/L)、高浓度蓝藻的水体中(Chl.a=300 μg/L),有蚌组的光照强度仅比无蚌组高了46%和31%,且有蚌组的苦草相对生长率显著高于无蚌组[39].目前,相关研究工作已经展开,如国家科技部重大专项子课题“太湖梅梁湾水源地水质改善技术”在工程示范区投放螺蛳31 t、蚬55 t、蚌30 t,通过这些螺、贝类的生物净化作用为水生高等植物的移植与恢复创造条件,从而达到改善太湖梅梁湾水源地水质的目的[40].本实验河蚬处理组中水体悬浮物与Chl.a浓度以及水体浊度均明显下降,而太湖水质状况多年来却没有得到较大改善.一方面可能是因为太湖是典型的大型浅水湖泊,极易在风浪作用下发生沉积物再悬浮[41],导致上覆水中营养盐浓度上升,促进浮游藻类大量生长,从而影响河蚬的水质净化作用;另一方面可能与外源营养负荷输入有关,本实验没有添加营养盐,而太湖日均外源磷负荷输入为5 μg/L,氮为130 μg/L,这也在一定程度上制约了河蚬对太湖水质改善的效果;除此之外,人类的大量捕捞也是导致河蚬数量下降的重要原因之一.因此,保护河蚬资源对于湖泊生态修复、沉水植物重建以及富营养化治理都有重要作用.
4 结论河蚬的滤食可以降低水体悬浮物浓度和Chl.a浓度,起到净化水体的作用,且净化效果表现为高蚬组>中蚬组>低蚬组>对照组.河蚬在一定密度范围之内可以有效降低水体TN、TP含量,使得水体浊度下降、水体底层附着藻类生物量上升,对富营养水体修复有重要意义.
| [1] |
马健荣, 邓建明, 秦伯强等. 湖泊蓝藻水华发生机理研究进展. 生态学报, 2013, 33(10): 3020-3030. |
| [2] |
Kairesalo T, Laine S, Luokkanen E. The ecological bases for lake and reservoir management. Dordrecht: Springer Netherlands, 1999, 99-106.
|
| [3] |
秦伯强, 高光, 胡维平等. 浅水湖泊生态系统恢复的理论与实践思考. 湖泊科学, 2005, 17(1): 9-16. |
| [4] |
吴庆龙, 陈宇炜, 刘正文. 背角无齿蚌对浮游藻类的滤食选择性与滤水率研究. 应用生态学报, 2005, 16(12): 2423-2427. DOI:10.3321/j.issn:1001-9332.2005.12.040 |
| [5] |
Zhou Y, Yang HS, Zhang T et al. Influence of filtering and biodeposition by the cultured scallops Chlamys farreri on benthic-pelagic coupling in a eutrophic bay in China. Marine Ecology Progress Series, 2006, 317: 127-141. DOI:10.3354/meps317127 |
| [6] |
周毅, 杨红生, 张福绥. 海水双壳贝类的生物沉积及其生态效应. 海洋科学, 2003, 27(2): 23-26. |
| [7] |
Naddafi R, Pettersson K, Eklov P. The effect of seasonal variation in selective feeding by zebra mussels (Dreissena polymorpha) on phytoplankton community composition. Freshwater Biology, 2007, 52: 823-842. DOI:10.1111/fwb.2007.52.issue-5 |
| [8] |
Hosper SH. Biomanipulation, new perspective for restoring shallow eutrophic lakes in the Netherlands. Hydrobiology Bulletin, 1989, 23(1): 5-10. DOI:10.1007/BF02286422 |
| [9] |
Caraco NF, Cole JJ, Raymond PA et al. Zebra mussel invasion in a large, turbid river: Phytoplankton response to increased grazing. Ecology, 1997, 78(2): 588-602. DOI:10.1890/0012-9658(1997)078[0588:ZMIIAL]2.0.CO;2 |
| [10] |
杨东妹, 陈宇炜, 刘正文等. 背角无齿蚌滤食对营养盐和浮游藻类结构影响的模拟. 湖泊科学, 2008, 20(2): 228-234. DOI:10.18307/2008.0215 |
| [11] |
费志良, 潘建林, 徐在宽等. 三角帆蚌对水体悬浮物和叶绿素a消除量的研究. 海洋湖沼通报, 2005(2): 40-45. |
| [12] |
潘建林, 徐在宽, 唐建清等. 湖泊大型贝类控藻与净化水质的研究. 海洋湖沼通报, 2007(2): 69-79. |
| [13] |
张虎才, 陈玥, 樊红芳等. 河蚬分布的气候环境及壳体稳定同位素. 海洋地质与第四纪地质, 2007, 27(3): 77-84. |
| [14] |
曹文明, 周刚, 盛建明等. 太湖河蚬资源现状及演变. 南京林业大学学报:自然科学版, 2000(z1): 125-128. |
| [15] |
蔡永久, 龚志军, 秦伯强. 太湖软体动物现存量及空间分布格局(2006-2007年). 湖泊科学, 2009, 21(5): 713-719. |
| [16] |
蔡炜, 蔡永久, 龚志军等. 太湖河蚬时空格局. 湖泊科学, 2010, 22(5): 714-722. |
| [17] |
黄祥飞. 湖泊生态调查观测与分析. 北京: 中国标准出版社, 2000.
|
| [18] |
金相灿, 屠清瑛. 湖泊富营养化调查规范. 北京: 中国环境科学出版社, 1990.
|
| [19] |
周会, 刘丛强, 李心清等. 贵阳南明河河蚬壳体微量元素变化特征及其与河水污染的关系研究. 贵州科学, 2008(1): 39-44. |
| [20] |
Doris S, Guillerm M. Filter feeding by the freshwater mussel, Diplodon chilensis, as a biocontrol of salmonfarming eutrophication. Aquaculture, 1999, 171: 65-81. DOI:10.1016/S0044-8486(98)00420-7 |
| [21] |
Hakenkamp C, Palmer M. Introduced bivalves in freshwater ecosystems: the impact of Corbicula on organic matter dynamics in a sandy stream. Oecologia, 1999, 119(3): 445-451. DOI:10.1007/s004420050806 |
| [22] |
McMahon RF. Evolutionary and physiological adaptations of aquatic invasive animals: r selection versus resistance. Canadian Journal of Fisheries and Aquatic Sciences, 2002, 59(7): 1235-1244. DOI:10.1139/f02-105 |
| [23] |
Asmus RM, Asmus H. Mussel beds: limiting or promoting phytoplankton?. Journal of Experimental Marine Biology and Ecology, 1991, 148(2): 215-232. DOI:10.1016/0022-0981(91)90083-9 |
| [24] |
刘旭博, 李柯, 周德勇等. 三角帆蚌对蓝藻的滤食作用及其对沉水植物生长的影响. 水生态学杂志, 2011, 32(2): 17-24. |
| [25] |
Vadeboncoeur Y, Steinman A. Periphyton function in lake ecosystems. The Scientific World Journal, 2002, 2: 1449-1468. DOI:10.1100/tsw.2002.294 |
| [26] |
Libouriussen L, Jeppesen E. Temporal dynamics in epipelic, pelagic and epiphytic algal production in a clear and turbid shallow lake. Freshwater Biology, 2003, 48(3): 418-431. DOI:10.1046/j.1365-2427.2003.01018.x |
| [27] |
Woodruff SL, House WA, Callow ME et al. The effects of biofilms on chemical processes in surficial sediments. Freshwater Biology, 1999, 41(1): 73-89. DOI:10.1046/j.1365-2427.1999.00387.x |
| [28] |
McCormick PV, O'Dell MB, Shuford Ⅲ RBE et al. Periphyton responses to experimental phosphorus enrichment in a subtropical wetland. Aquatic Botany, 2001, 71(2): 119-139. DOI:10.1016/S0304-3770(01)00175-9 |
| [29] |
宋玉兰, 秦伯强, 高光. 附着生物对富营养化水体氮磷的去除效果. 长江流域资源与环境, 2008(2): 18-26. |
| [30] |
张雷, 古小治, 邵世光等. 河蚬(Corbicula fluminea)扰动对湖泊沉积物性质及磷迁移的影响. 环境科学, 2011, 32(1): 88-95. |
| [31] |
Lohner RN, Sigler V, Mayer CM et al. A comparison of the benthic bacterial communities within and surrounding Dreissena clusters in lakes. Microbial Ecology, 2007, 54(3): 469-477. DOI:10.1007/s00248-007-9211-8 |
| [32] |
Bruesewitz DA, Tank JL, Bernot MJ. Delineating the effects of zebra mussels (Dreissena polymorpha) on N transformation rates using laboratory mesocosms. Journal of the North American Benthological Society, 2008, 27(2): 236-251. DOI:10.1899/07-031.1 |
| [33] |
Kautsky N, Wallentinus I. Nutrient release from a Baltic Mytilus-red algal community and its rote in benthic and pelagic productivity. Ophelia, 1980(suppl): 17-30. |
| [34] |
徐海军, 凌去非, 杨彩根等. 3种淡水贝类对藻类消除作用的初步研究. 水生态学杂志, 2010, 3(1): 72-75. |
| [35] |
Karatayev AY, Padilla DK, Minchin D et al. Changes in global economies and trade: the potential spread of exotic freshwater bivalves. Biological Invasions, 2007, 9(2): 161-180. DOI:10.1007/s10530-006-9013-9 |
| [36] |
Gutiérrez JL, Jones CG, Strayer DL et al. Mollusks as ecosystem engineers: the role of shell production in aquatic habitats. Oikos, 2003, 101(1): 79-90. DOI:10.1034/j.1600-0706.2003.12322.x |
| [37] |
Cantanhêde G, Hahn NS, Gubiani EA et al. Invasive molluscs in the diet of Pterodoras granulosus (Valenciennes, 1821)(Pisces, Doradidae) in the upper Paraná River floodplain, Brazil. Ecology of Freshwater Fish, 2008, 17(1): 47-53. DOI:10.1111/eff.2008.17.issue-1 |
| [38] |
Gergs R, Rinke K, Rothhaupt KO. Zebra mussels mediate benthic-pelagic coupling by biodeposition and changing detrital stoichiometry. Freshwater Biology, 2009, 54: 1379-1391. DOI:10.1111/fwb.2009.54.issue-7 |
| [39] |
He H, Liu XB, Liu XL et al. Effects of cyanobacterial blooms on submerged macrophytes alleviated by the native Chinese bivalve Hyriopsis cumingii: A mesocosm experiment study. Ecological Engineering, 2014, 71: 363-367. DOI:10.1016/j.ecoleng.2014.07.015 |
| [40] |
史龙新, 张运林, 秦伯强. 太湖梅梁湾水源地示范区水质改善初探. 长江流域资源与环境, 2006, 15(2): 232-236. |
| [41] |
罗潋葱, 秦伯强, 胡维平等. 不同水动力扰动下太湖沉积物的悬浮特征. 湖泊科学, 2004, 16(3): 273-275. DOI:10.18307/2004.0313 |
 2015, Vol. 27
2015, Vol. 27 

